Three-dimensional analysis of the umbilical vein and the ductus venosus at the human embryonic and early fetal stages
ヒト胚子期・胎児期初期における臍帯静脈と静脈管の3次元的解析
磯谷 菜穂子
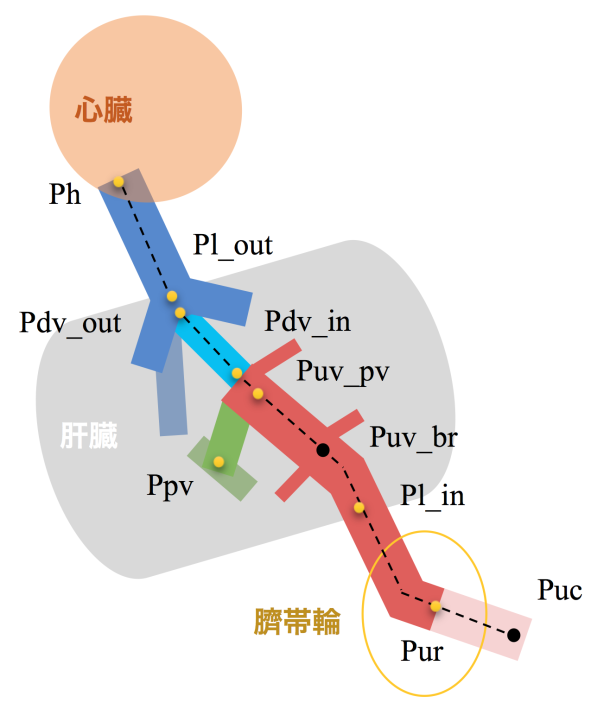
【背景】臍帯から心臓までの静脈系短絡路については、領域によって、発生機序や出生後の運命、隣接する器官や機能が異なることが知られている。これらの違いにより、この短絡路には領域ごとに形態学的、組織学的な違いがあることが予想される。本研究では、短絡路全体を俯瞰する総論的視点と、領域ごとに形態学的特徴を検討する各論的な視点の両面から各領域における形態・走行や血管壁の特徴を明らかにした。
【対象・方法】京都大学大学院医学研究科附属先天異常標本解析センター保有のヒト胚子、胎児期初期標本の立体情報計29例(位相CT;18例(Carnegie stage(CS)15~23)、MRI;11例(頭殿長(CRL)= 33mm~97mm))とヒト胚子標本の連続組織切片画像18例(CS15~23)を対象とした。位相CT、MRIの画像情報をもとに短絡路の立体像を作成し、1)立体像の観察2)血管内腔の大きさと形状の可視化3)空間座標を用いた走行・形態の解析4)定量的解析を行った。組織切片画像を用いて5)血管壁の組織学的検討を行った。
【結果】1)立体像の観察:臍帯静脈は臍帯輪から肝臓へ向かって走行し、肝臓内の方形葉と右葉の内下隅でいくつかの分枝を生じた。肝内臍帯静脈はさらに肝臓内を近位方向へ走行し、肝臓尾状葉の尾側端で三股に分岐した。この間、臍帯静脈の分枝は見られなかった。これらは例外なくCS15からCRL97mmまで観察された。
2)血管内腔の大きさと形状の可視化:CS15~17では臍帯静脈の臍帯輪周囲が最も太いが、個体が成長すると肝臓内の部分や下大静脈の部分へと最大内腔を持つ部分は変化した。臍帯静脈はCS21頃を境に内腔が不均一で凹凸がある形態から比較的円形で均一な形態へ変化した。
3)空間座標を用いた走行・形態の解析:短絡路の臍帯輪や椎体との位置関係は個体の成長によって腹腔内で変化し、胎児期ではより腹壁に近い位置を走行するようになった。短絡路の走行方向はCRL40mm頃までに正中面に平行し、CRL50mm頃からは平面上で頭尾方向へ立ち上がるような変化があった。プロクラステス解析では臍帯静脈の4つの形態パターンが明らかになり、このパターンは成長に伴って変化した。
4)定量的解析:短絡路の全長は成長に伴って増加した。全長に対する各領域の血管長の割合に大きな変化はなく、臍帯静脈が50%以上を占めたが、肝内と肝外の血管割合には変化があった。湾曲率はどの領域でも胚子期の小さい個体で比較的に高い傾向にあった。静脈管の湾曲率はCRL10mm頃までに急激に低下し、その後ほぼ一定であった。
5)血管壁の組織学的検討:臍帯静脈ではCS20頃から部分によって血管壁の厚みや肝臓との接着方法に違いが見られた。静脈管はほとんどの部分で血管壁が薄いが、CS20から入口部分に血管壁の隆起が限局的に見られた。 【結論】臍帯から心臓までの静脈系短絡路について、形成直後であるCS15から胎児期初期のCRL97mmまで立体像を作成し、その経時的変化を総論的視点と各論的な視点の両面から形態学的、形態計測学的、組織学的に明らかにした。
67. Isotani N, Kanahashi T, Imai H, Yoneyama A, Yamada S, Takakuwa T. Regional differences in the umbilical vein and ductus venosus at different stages of normal human development. Anat Rec (Hoboken), 2024, 307, 3306-3326.DOI:10.1002/ar.25421
Morphogenesis of the pulmonary vein and the left atrial appendage in human embryos and early fetuses
ヒト胚子・胎児期初期における肺静脈・左心耳の形態形成
福井 成美
【背景】左心房は心臓心底部の大部分を形成する。心底からは4 本の肺静脈が流入し、前面側には狭窄部を介して左心耳が接合している。発生4週目末頃、左心房後壁から総肺静脈が突出する。その後、総肺静脈と4本の肺静脈の近位部は拡張し、左心房壁に取り込まれ、最終的に4本の肺静脈が左心房から直接突出する。左心耳は原始左心房に由来し、発生4週目に形成される。成人の左心耳は 1~4 つの分葉構造を持ち、内部は櫛状筋によって櫛状構造になっている。肺静脈の取り込み完了時期は文献によって様々であり、左心耳の形態形成については成人例のみ報告されている。そこで、高解像度の画像データと 3 次元情報から肺静脈の取り込み過程と左心耳の発生について検討する。
【対象と方法】ヒト胚子標本計 24 例、ヒト胎児標本計20 例とした。位相 CT 撮像を行って取得した CT 画像と高解像度 MRI 撮像を行って取得した MR 画像上で、肺静脈を観察した。MR 画像をもとに心臓部分の立体像を再構築し、肺静脈と左心耳の形態学的観察と定量的評価を行った。
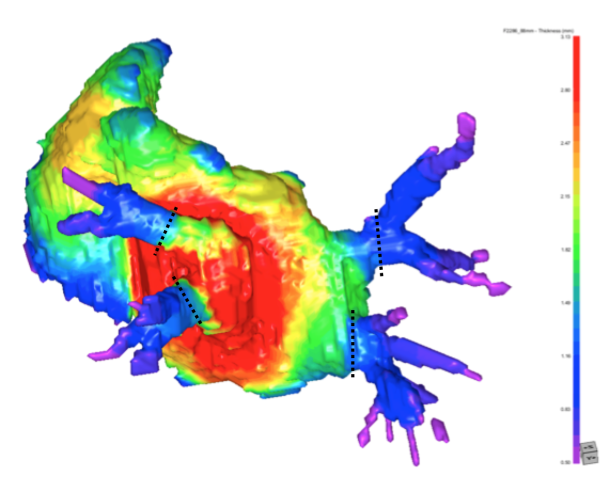
【結果】観察された肺静脈の本数は、CS17~18 で 1 本、CS18~21 で 2 本または 4 本、CS22以降で 3 本または 4 本であった。肺静脈が 2 本以上ある標本では、CRLの増加に伴い、 左右の肺静脈の距離が長くなり、左右の肺静脈間の左心房の厚みも増加した。上下の肺静脈間の距離は左右の肺静脈間の距離よりも近かった。肺静脈が 2 本の場合、肺静脈は背側から左心房内に流入し、肺静脈が 3 本または 4 本の場合、肺静脈は左心房へ背側の外側から内側へ接線方向に入り込んだ。肺静脈の断面積については、左上肺静脈が最も小さい傾向にあり、他の3 本の肺静脈は類似していた。形状は左上肺静脈が最も扁平であり,他の 3 つの肺静脈は類似していた。左心耳の最も厚みのある部分は中心付近であり、そこから放射状に薄くなった。左心耳の開口部は CRLの増加に伴い断面積が増大し、扁平化する傾向にあった。
【結論】肺静脈の取り込みは CS18 頃から始まり、CS18~22 で完了すると考えられる。左上肺静脈の近位部は他の 3 つの肺静脈より断面積は小さく、より扁平である。胚子期後期より、3 本または 4 本の肺静脈は外側より左心房に流入し、左右の肺静脈より上下の肺静脈間の距離のほうが近い。左心耳は中心付近が最も厚く、そこから放射状に薄くなっていく。左心耳の開口部は CRL に伴い断面積が増大し、扁平化する。
[Background] The left atrium (LA) forms the bulk of the cardiac fundus. Four pulmonary veins (PVs) flow from the fundus, and the left appendage (LAA) is joined to the anterior side via a stenosis. Toward the end of the fourth week of development, the common pulmonary vein (CPV) protrudes from the posterior wall of the LA. The CPV and the proximal portions of the four PVs dilate and are taken up by the LA wall, and finally, the four PVs protrude directly from the left atrium. The LAA originates from the primordial LA and forms during the fourth week of development. The adult LAA has one to four lobe-like structures, and the interior of the LAA has a comb-like structure created by pectinate muscles. The time of completion of the PV uptake into the LA wall has been controversial in previous studies, and morphogenesis of the LAA has been reported only in adult cases. We provided the data showing the PV uptake process and the LAA development based on high-resolution image data and three-dimensional information.[Materials & Methods] Twenty-four human embryos and twenty fetuses were selected for this study. The PV was observed on CT images obtained by phase CT imaging and MR images obtained by high-resolution MRI imaging. 3D images of the heart portion were reconstructed based on the MR images, and morphological observation and quantitative evaluation of the PVs and LAA were performed.
[Results] The number of PV was one from CS 17 to CS 18, two or four from CS 18 to CS 21, and three or four after CS 22. In specimens with two or more PVs, the distance between the left and right PVs increased with CRL, as did the reconstruction of the LA thickness between the left and right-sided PV. The distance between the superior and inferior PVs was closer than between the left and right-sided PVs. When there were two PVs from CS18 to CS 21, they flowed into the LA from the dorsal side; when there were three or four PVs, they entered tangentially into the dorsal part of the LA from the lateral to medial direction. Regarding the cross-sectional area of the PV, the LSPV was the smallest, while the other three PVs were similar. In shape, the LSPV was the most flattened; the other three PVs were similar. The LAA thickness was thickest near the center, and it became radially thinner from there. The LAA orifice increased in area and tended to become more flattened with CRL.
[Conclusion] The PV uptake is thought to begin around CS 18 and complete from CS 18 to CS 22. The proximal portion of the LSPV is smaller in cross-sectional area and circumference than the other three PVs and is more flattened. Four PVs enter tangentially into the dorsal part of the LA from the lateral to medial direction. And the distance between the superior and inferior PV is closer than between the left and right-sided PV. The LAA thickness is thickest near the center, and it becomes radially thinner from there. The LAA orifice is found to increase in area and become more flattened with CRL.
61. Fukui N, Kanahashi T, Matsubayashi J, Imai H, Yoneyama A, Otani H, Yamada S, Takakuwa T. Morphogenesis of the pulmonary vein and left atrial appendage in human embryos and early fetuses. J Anatomy 2023, in press, https://doi.org/10.1111/joa.13941
Three-dimensional imaging analysis of developmental process of posterior meniscofemoral ligament in rat embryo
ラット胎仔における後半月大腿靭帯の発生機序の三次元的解析
石田かのん
【目的】膝関節の後半月大腿靭帯(pMFL)は、膝関節安定への寄与や円盤状外側半月板(DLM)との関連が報告されているが、健常な膝におけるその発生過程は調査されていない。本研究では二次元的な発生過程の観察に加えて三次元再構成像を用いた解析を行った。倫理的制約のため、ヒトと膝の構造が類似し、複数の胎仔を得られるラットを対象とした。本研究の目的はラット膝関節のpMFLの発生過程を三次元的に解析し、他の膝関節構成体との関係を検討することであった。
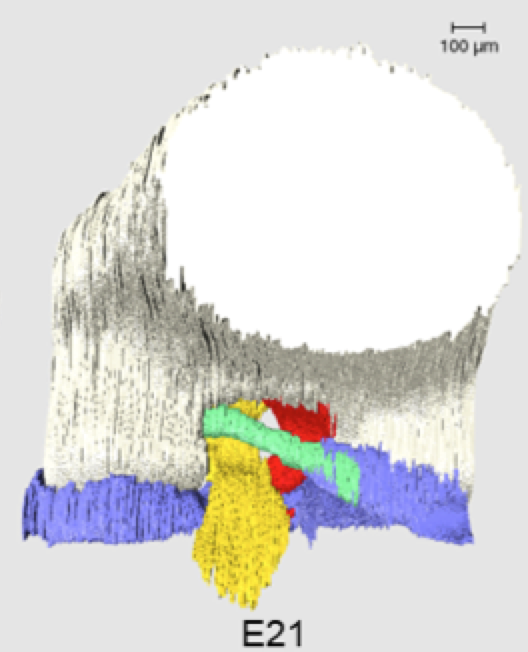
【方法】胎生期16日目~21日目(E16~E21)のWistarラットの後肢の形態と位置をHE染色で確認した。次に、自家蛍光を画像化するepiscopic fluorescence image capture (EFIC)によって、E17~E21のそれぞれについて連続画像を撮影した。三次元像の再構成と計測は三次元画像解析ソフトAmiraで行った。pMFLの長さ、たわみ、角度、体積を測定した。前十字靭帯(ACL)、後十字靭帯(PCL)、半月板の体積も測定し、pMFLを含む各構成体のE17の平均値に対する体積の割合を比較した。
【結果】pMFLはE17から観察され、全段階で大腿骨内側顆と外側半月板に付着していた。pMFLの長さ及び各膝関節構成体の体積はE19~E21の間に有意に増加したが、pMFLのたわみと角度には全段階を通して有意な変動は認められなかった。体積の割合は、E19まで全ての構成体が同程度の増加傾向を示したが、E20以降は半月板とPCLが顕著に増加した。
【考察】pMFLの長さや各構成体の体積がE19以降に有意に増加したのに対し、角度の変動が対象期間を通して少なかったことは、pMFLと周囲の構成体が位置関係を保ちながら発達することを示唆する。pMFLが大腿骨に付着する位置が高いとDLMを引き起こす可能性があり、今回の結果はDLMの発生機序の理解に役立つ可能性がある。また、ラットの後肢運動がE16~E19の間に増加するとの報告と比較するとpMFLの長さと各構成体の体積が顕著に増加する時期はこれの直後にあたり、発生過程は二段階に分かれていると考えられる。ラットはヒトと荷重のかかり方が異なるため、ヒト膝における発生過程についてさらなる研究が必要である。
【結論】ラットのpMFL及び膝関節構成体の発生過程を三次元的に解析した。本研究は正常なpMFL及び膝関節構成体の発生過程を提示し、解剖のより良い理解に貢献する。
Objectives: The posterior meniscofemoral ligament (pMFL) of the knee joint has been reported to contribute to knee joint stability and to be associated with the discoid lateral meniscus (DLM); however, its developmental process in healthy knees has not been studied. In this study, we analyzed the developmental process using three-dimensional (3D) reconstructed images in addition to two-dimensional observations. Owing to ethical constraints, rats were selected for this study because of the advantage of their similar knee structure to humans and the availability of multiple fetuses. The purpose of this study was to analyze pMFL development in rat knee joints three-dimensionally and examine its relationship with other knee joint components.
Methods: The shape and position of hindlimbs of Wistar rats at E16-E21 were confirmed with HE-stained tissue sections. Serial episcopic fluorescence images of the hindlimbs of E17-E21 were respectively captured by episcopic fluorescence image capture (EFIC), from which 3D images were reconstructed using Amira software. The pMFL length, deflection, angle, and volume were measured in 3D images. The volumes of the anterior cruciate ligament (ACL), posterior cruciate ligament (PCL), and menisci were also measured and the ratio of the volume to the mean value at E17 of each component, including pMFL, was compared.Results: pMFL was observed from E17 and was attached to the medial femoral condyle and lateral meniscus at all stages. The pMFL length and volume of each knee joint component increased significantly between E19 and E21; no significant variation was observed in the pMFL deflection and angle throughout all phases. The Volume ratios showed that all components showed similar increasing trends until E19, but the menisci and PCL increased significantly from E20.
Discussion: While the length of pMFL and volume of each component increased significantly after E19, there was little variation in angle throughout the stages studied, suggesting that the pMFL and surrounding components developed with a positional relationship. A higher attachment position of the pMFL to the femur may cause DLM , and the present results may help in understanding the mechanism of DLM development. When compared with a report that hindlimb movement in rats increases between E16 and E19, the time when the length of pMFL and volume of each component significantly increased is just after this, indicating that the developmental process is divided into two phases. As rat knees are loaded differently from human knees, further studies are required on the developmental process of human knees.
Conclusion: The developmental process of pMFL and knee joint components in rat embryos was analyzed three-dimensionally. This study improves our understanding of the developmental processes of the normal pMFL and knee joint components.
Ishida K, Ishikawa A, Yamada S, Takakuwa T, Aoyama T, Three-dimensional imaging analysis of the developmental process of posterior meniscofemoral ligaments in rat embryos. Cells Tissues Organs 2024, in press, DOI: 10.1159/000536108